El ácido aspártico o su forma ionizada, el aspartato (símbolos Asp y D) es uno de los veinte aminoácidos con los que las células forman las proteínas. En el ARN se encuentra codificado por los codones GAU o GAC. Presenta un grupo carboxilo (-COOH) en el extremo de la cadena lateral. Su fórmula química es HO2CCH(NH2)CH2CO2H.
A pH fisiológico, tiene una carga negativa (es ácido); pertenece al grupo de aminoácidos con cadenas laterales polares cargadas. No es un aminoácido esencial ya que puede ser sintetizado por el organismo humano. Su biosíntesis tiene lugar por transaminación del ácido oxalacético, un metabolito intermediario del ciclo de Krebs.
El aspartato no es esencial en mamíferos, siendo producido a partir del oxalacetato por una reacción de transaminación. También se sintetiza del dietil sodio eftalimidomalonato, (C6H4(CO)2NC(CO2Et)2).
El aspartato participa en la formación de glutamato a través de la glutamato-aspartato transaminasa citosólica.
El aspartato es también un metabolito del ciclo de la urea y participa en la gluconeogénesis
El mecanismo de inactivación es la recaptación. Se han descrito distintos sistemas de transporte en las membranas neuronales y gliales. En la neurona está el EGAC1, que transporta glutamato y aspartato. En la célula glial está el GLAST (aspartato-glutamato). Estos sistemas de transporte son dependientes de sodio e independiente de cloro.
Los receptores para aspartato son un mundo muy complejo. Los hay ionotrópicos y metabotrópicos. Estimula los receptores NMDA, aunque no tan fuertemente como la hace el glutamato.
El aspartato es uno de los aminoácidos que actúan como neurotransmisores.
Saltar a navegación, búsqueda

Imagen de la Alanina
Alanina (Ala o A) es uno de los aminoácidos que forman las proteínas de los seres vivos. En el ARN mensajero está codificada como GCU, GCC, GCA o GCG.
Es una molécula hidrófobica con un grupo metilo. Es el aminoácido más pequeño después de la glicina.
La alanina es un ácido 2-aminopropanoico, un α-aminoácido no esencial. Existe en dos distintos enantiómeros – L-alanina y D-alanina. La L-alanina es uno de los 20 aminoácidos más ampliamente usados en biosíntesis de proteína, detrás de la leucina, encontrándose en un 7,8 % de las estructuras primarias, en una muestra de 1.150 proteínas.[1] La D-alanina está en las paredes celulares bacteriales y en algunos péptidos antibióticos. La alanina es un aminoácido no esencial utilizado por el organismo para sintetizar proteínas. Se encuentra tanto en el interior como en el exterior de las proteínas globulares. También es uno de los aminoácidos no esenciales que interviene en el metabolismo de la glucosa.
El átomo alfa carbono α-carbono de la alanina está enlazado con un grupo metil (-CH3), haciéndolo uno de los más simples α-aminoácidos con respecto a la estructura molecular, resultando en que la alanina sea clasificada como un aminoácido alifático.
La alanina es muy común por transferir su grupo amino al piruvato. Debido a las reacciones de transaminación es rápidamente reversible, por lo tanto la alanina puede fácilmente biosintetizarse del piruvato, por lo que está presente en los ciclos metabólicos de la glicólisis, gluconeogénesis, y en el ciclo del ácido cítrico.
El grupo metil de la alanina es muy no reactivo, por lo que no es común verlo en la función protéica. Sin embargo, élla puede jugar un rol en el reconocimiento del sustrato o especificidad, particularmente en interacciones con otros átomos no reactivos como el carbono. interviene en el metabolismo de la glucosa
En el “ciclo de la alanina” genera glucosa de proteínas.
Cualquier proteína de los alimentos: carne vacuna, cerdo, pescado, huevos, productos lácteos son ricos en alanina.
La arginina, en su isómero óptico “levógiro” (denominado L-Arginina) es uno de los 20 aminoácidos que se encuentran de forma natural en la Tierra, formando parte de las proteínas. En tejidos extrahepáticos, la arginina puede ser sintetizada en el ciclo de la ornitina (o ciclo de la urea). Sus codones son CGU, CGC, CGA, CGG, AGA, y AGG. Se clasifica, en población pediátrica, como uno de los 10 aminoácidos esenciales. Sus símbolos son Arg y R. Este aminoácido se encuentra involucrado en muchas de las activides de las glándulas endocrinas.[1]
La arginina es un aminoácido esencial, y puede estimular la función inmunológica al aumentar el número de leucocitos. La arginina está involucrada en la síntesis de creatina, poliaminas y en el ADN. Puede disminuir el colesterol mejorando la capacidad del aparato circulatorio,[2] así como estimular la liberación de hormona de crecimiento (somatropina),[3] reducir los niveles de grasa corporal y facilitar la recuperación de los deportistas debido a los efectos que tiene de retirar amoníaco (residuo muscular resultante del ejercicio anaeróbico) de los músculos y convertirlo en urea que se excreta por la orina.[4] Se emplea en la biosíntesis de la creatina. Se suele encontrar en ciertos productos ergogénicos que contienen óxido nitroso (NO) ya que potencia los efectos vasodilatadores. []
[]La arginina se encuentra en la gran mayoría de productos del mar, pescado, mariscos, crustáceos, grandes mamíferos acuáticos como las ballenas hacen un aceite con ellas, ese aceite es demandado por diversas empresas cosméticas por su contenido en arginina.
La arginina se sintetiza de citrulina por acción secuencial de las enzimas citosólicas argininosuccinato sintetasa (ASS) y de la argininosuccinato liasa (ASL). Esto es energéticamente costoso, ya que la síntesis de cada molécula de argininosuccinato requiere la hidrólisis de adenosin trifosfato (ATP) a adenosín monofosfato (AMP); i.e., dos ATP equivalentes.
La Citrulina puede proveerse de múltiples fuentes:
Los caminos de enlaces arginina, glutamina, prolina son bidireccionales. O sea, la utilización neta o producción de esos aminoácidos es altamente dependiente del tipo de célula y del estadio de desarrollo.
En el cuerpo, la síntesis de arginina ocurre principalmente vía el eje intestinal–renal, donde los epitelios del intestino delgado, que produce citrulina primariamente desde la glutamina y de glutamato, colabora con las células tubulares proximales del páncreas, que extrae citrulina de la circulación y la convierte en arginina, que es colocado en la circulación. Consecuentemente, anomalías intestinales o de función renal puede reducir la síntesis endógena de arginina, haciendo necesario subir el requerimiento del aminoácido en la dieta.
La síntesis de arginina desde la citrulina ocurre a bajo nivel en muchos otros tejidos, y la capacidad tisular de sintetizar arginina puede incrementarse marcadamente bajo circunstancias que también inducen la sintetasa óxido nítrico (iNOS). Así, la citrulina, un coproducto de la reacción NOS-catalizada, puede reciclarse a arginina en el camino bioquímico citrulina-NO o camino arginina-citrulina. Esto se demuestra por el tipo de tejidos, la citrulina puede substituirse por arginina en varios grados para soportar la síntesis de NO. Sin embargo, la citrulina se acumula junto con nitratos y nitritos, las formas finales estables de NO, en las células productoras de NO.[7] [8]
La glicina (Gly, G) es uno de los aminoácidos que forman las proteínas de los seres vivos. En el código genético está codificada como GGT, GGC, GGA o GGG.
Es el aminoácido más pequeño y el único no quiral de los 20 aminoácidos presentes en la célula. Su fórmula química es NH2CH2COOH y su masa es 75,07. La glicina es un aminoácido no esencial. Otro nombre (antiguo) de la glicina es glicocola.
La glicina actúa como neurotransmisor inhibidor en el sistema nervioso central. Fue propuesta como neurotransmisor en 1965.
La glicina se utiliza -in vitro- como medio gástrico, en disolución 0,4 M, amortiguada al pH estomacal para determinar bioaccesibilidad de elementos potecialmente tóxicos (metales pesados) como indicador de biodisponibilidad.
La glicina no es esencial en la dieta humana, ya que el propio cuerpo se encarga de sintetizarla. Todas las células tienen capacidad de sintetizar glicina. Hay dos vías para sintetizarla: la fosforilada y la no-fosforilada. El precursor más importante es la serina. La fosfoserina fosfatasa, desfosforila a la fosfoserina hasta serina. La enzima serina hidroximetil transferasa da lugar a la glicina a partir de la serina. La glicina usada como neurotransmisor es almacenada en vesículas, y es expulsada como respuesta a sustancias.
Industrialmente se prepara mediante una reacción de un solo paso entre el ácido cloroacético y el amoníaco.
ClCH2COOH + NH3 → H2NCH2COOH + HCl
El mecanismo de recaptación es dependiente de sodio y cloruro.
La glicina tiene un receptor (distinto de los receptores para el GABA) que además puede unir β-alanina, taurina, L-alanina, L-serina y prolina. No se activa con GABA. Un antagonista es el alcaloide estricnina, que bloquea la glicina y no interactúa con el sistema del GABA. Aumenta la conductancia para el cloro (parecido al receptor de la glicina al GABA-A).
Este receptor se ha purificado utilizando el alcaloide estricnina. Este receptor es un complejo de subunidades α y β, con estructura pentamérica, con homología al GABA-A y el receptor nicotínico. También posee 4 dominios transmembranales. En el citosol, se unen a gefinina para anclarse al citoesqueleto. Se piensa que otros receptores ionotrópicos pueden tener un sistema similar de anclaje a la membrana.
Esquema que muestra cómo la glicina participa en la estructura de las purinas
La glicina se utiliza para sintetizar gran número de sustancias; por ejemplo, el grupo C2N de todas las purinas se consigue gracias a la glicina. También es un neurotransmisor inhibidor en el sistema nervioso central, especialmente en la médula espinal, tallo cerebral y retina.

La leucina (abreviada Leu o L) es uno de los veinte aminoácidos que utilizan las células para sintetizar proteínas. Está codificada en el ARN mensajero como UUA, UUG, CUU, CUC, CUA o CUG. Su cadena lateral es no polar, un grupo isobutilo (2-metilpropilo).
Los aminoácidos ramificados (denominados también como aminoácidos de cadena ramificada en inglés se denominan BCAA de Branched-Chain Amino Acids) se refiere a un tipo de aminoácidos que posee un compuesto alifático que son no lineales (su nombre proviene de esta característica ramificada). Entre ellos se encuentran la leucina, la isoleucina y la valina. Se trata de los aminoácidos más hidrófobo) Algunos se biosintetizan en el organismo y otros se ingieren vía una dieta adecuada.La combinación de estos tres aminoácidos esenciales compone casi la tercera parte de los músculos esqueléticos en el cuerpo humano y juegan un papel muy importante en la síntesis de proteínas. Los aminoácidos de cadena ramificada se emplean frecuentemente en los tratamientos de los pacientes que han sufrido quemaduras, así como en la suplementos dietéticos de los atletas que practican musculación.[1]
Una de las principales funciones de este tipo de aminoácidos es la síntesis protéica.[2] La oxidación de los BCAA tiene como función propocionar energía metabólica a los músculos así como a otros óganos solicitantes de ella, así como de ser precursores de la síntesis de los aminoácidos siendo un favorecedor de la sintesis de la alanina y la glutamina en los estados catabólicos.[3] El catabolismo desgasta el músculo esquelético generando un balance de nitrógeno negativo en los tejidos. Los BCAA detienen la proteólisis tanto en sujetos vivos como en muestras de laboratorio. Este tipo de aminoácidos es captado con ‘avidez’ por el músculo provocando ciertos efectos ergogénicos, principalmente deteniendo el efecto catabólico y favoreciendo la síntesis protéica. El contenido de aminoácidos de cadena ramificada crece durante las primeras fases del ejercicio y posteriormente van disminuyendo.[4] La razón o velocidad de disminución depende directamente de la intensidad del ejercicio[5] Suelen incrementar los niveles de serotonina cuando el cerebro recibe niveles elevados de triptófano (un aminoácido precursor de la serotonina).
La ingesta de aminoácidos, incluidos los BCAA, se absorben por el intestino delgado vía las células epiteliales mediante transportadores específicos de aminoácidos y son transportados al hígado por el torrente sanguíneo de la vena porta.[6] Los BCAA se emplean en el organismo como reguladores de la síntesis y degradación (proteólisis) de proteínas y son precursosres clave en la síntesis de la glutamina y alanina.[7] [8] Además la oxidación de los BCAA genera energía anaeróbica en los músculos. La oxidación de los BCAA es controlada a corto plazo por los productos sintetizados en la transaminación de la leucina[9] y a largo plazo por muchas condiciones fisiológicas y patológicas tales como la diabetes, el cancer, la sepsis y la infección.[10]
Se suele ingerir como suplemento dietético (fecuentemente como suplemento de musculación) con el objeto de evitar el denominado overtraining en los atletas de levantamiento de pesos y de musculación.[11] Su efecto en la disminución de la fatiga deportiva es una fuente de debate en la actualidad y existen estudios científicos con resultados contradictorios. Se aplica como suplemento dietético en pacientes que han tenido una operación quirúrgica o que sufren de cancer[3] debido a los procesos de catábolisis de proteinas que puedan sufir sus organismos. Se ha empelado como terapia en pacientes que sufren de discinesia.[12] Se ha empleado en la industria cárnica como suplemento alimenticio de ciertos animales y poder obtener carnes de calidad.[13] [14]
El uso como suplemento en deportes anaeróbicos suele hacerse en tomas con protocolos de dos tomas, generalmente media hora antes y después del ejercicio. Algunos autores mencionan dos tomas, pero media hora antes y ‘durante el ejercicio’.[15] [16] Otros han investigado el efecto de las tomas en periodos anteriores al descanso nocturno[17] pudiendo comprobar que no hay efectos en el crecimiento muscular. Los aminoácidos de cadena ramificada se distribuyen de muchas formas, en píldoras, en polvo, etc. Y existen una gran variedad de dosificaciones que van desde uno hasta cuarenta gramos por día. Los compuestos comercializados suelen tener un ratio de 2:1:1 (leucina:valina:isoleucina). Algunas recomendaciones mencionan una dosis de 1,500–6,000 mg/día de leucina y 800–3,000 mg/día tanto de isoleucina y valina. Se acoseja tomar los aminoácidos ramificados junto con suplementos de proteína o con carne magra, así como con múltiples vitaminas (dentro del grupo B) y minerales. Unos 5-20 gramos por día (en forma de tabletas/cápsulas) en dosis divididas durante el día (algunas de ellas durante el ejercicio) o tras el ejercicio en forma de líquido (de 1 a 7 gramos de BCAA por litro de bebida deportiva).
No se han detectado problemas o efectos secundarios en dosis por debajo de los seis gramos diarios,[16] aunque algunas marcas mencionan casos de intolerancia a la ingesta de aminoácidos ramificados (en estos casos se recomienda la parada de la suplementación). Consumir grandes cantidades de BCAA durante el ejercicio puede hacer disminuir la absorción de agua en el intestino lo que puede inducir a problemas gastrointestinales.
Estructura química de la lisina

Estructura química de la lisina
La lisina (abreviada Lys o K), también llamada L-lisina, es un aminoácido de entre los 8 esenciales para los seres humanos (esencial significa que no es sintetizado por las células humanas, y por tanto debe ingerirse con la dieta).
Químicamente es una base, al igual que la arginina y la histidina. Su fórmula química es HO2CCH(NH2)(CH2)4NH2. Sus codones son AAA y AAG.
La cadena lateral que caracteriza a la lisina es básica y contiene un grupo ε protonable que a menudo participa en puentes de hidrógeno y como base general en catálisis. Este grupo amino, además de proveer de carga positiva a las proteínas, es acetilable por enzimas específicas, conocidas como acetiltransferasas. Se considera que esta acetilación es una modificación post-traduccional, puesto que se produce después de la traducción de la proteína a partir del ARN mensajero. Sin embargo, sus modificaciones post-traduccionales más comunes incluyen la metilación del grupo ε-amino, que da como resultado la metil-, dimetil- y la trimetillisina. Esto último ocurre en la calmodulina. El colágeno contiene hidroxilisina, que se deriva de la lisina a través de la lisil hidroxilasa. La O–glicosilación de los residuos de lisina en el retículo endoplásmico o en el aparato de Golgi se utiliza para marcar ciertas proteínas para la secreción de la célula.
Como aminoácido esencial, la lisina no se sintetiza en el organismo de los animales y, por consiguiente, éstos deben ingerirlo como lisina o como proteínas que contengan lisina. Existen dos rutas conocidas para la biosíntesis de este aminoácido. La primera se lleva a cabo en bacterias y plantas superiores, a través del ácido diaminopimélico, y la segunda en la mayor parte de hongos superiores, mediante el ácido α-aminoadípico. En las plantas y en los microorganismos la lisina se sintetiza a partir de ácido aspártico, que se convierte en primer lugar en β-aspartil-semialdehído. La ciclización genera dihidropicolinato, que se reduce a [[Δ1-piperidina-2,6-dicarboxylato]]. La apertura del anillo de este heterociclo genera una serie de derivados del ácido pimélico, que finalmente generará lisina. Algunas de las enzimas que participan en esta biosíntesis son las siguientes:[1]
La lisina se metaboliza en los mamíferos para dar acetil-CoA, a través de una transaminación inicial con α-cetoglutarato. La degradación bacteriana de la lisina da como resultado cadaverina, a través de un proceso de descarboxilación.
La lisina sintética, racémica, se conoce desde hace mucho tiempo.[2] Una síntesis práctica inicia a partir de caprolactam.[3]
Los requerimientos nutricionales de lisina son de 1,5 g al día. En cantidades mínimas se encuentra en todos los cereales (gramíneas), pero es muy abundante en las legumbres.
Son buenas fuentes de lisina aquellos alimentos ricos en proteína: carnes (específicamente las carnes rojas, la de puerco y la de ave), queso (en particular el parmesano), algunos pescados (bacalao y sardinas) y huevos.
La L-lisina es un elemento necesario para la construcción de todas las proteínas del organismo. Desempeña un papel central en la absorción del calcio; en la construcción de las proteínas musculares; en la recuperación de las intervenciones quirúrgicas o de las lesiones deportivas, y en la producción de hormonas, enzimas y anticuerpos.
Se ha sugerido que la lisina puede ser benéfica para aquellas personas que presentan infecciones con herpes simple.[4] Sin embargo, hacen falta más estudios para corroborar esta afirmación. Véase Herpes simplex – Lysine.
Existen conjugados de lisina que resultan prometedoras para el tratamiento del cáncer, pues al parecer provocan que las células cancerosas se autodestruyan cuando el fármaco se utiliza en combinación con el uso de fototerapia, sin dañar a las células no cancerosas.[5]
La lisina, ingerida con L-carnitina, ayuda a que la carnitina disminuya notablemente los niveles de colesterol en la sangre.
Se dice también que la lisina ayuda al desarrollo mental, por lo que es bueno comenzar desde niño a consumir lisina.
La lisina estimula la liberación de la hormona del crecimiento. Esto ha hecho que se utilice, sola o combinada con otros aminoácidos, en niños para estimular el crecimiento y en ancianos para retrasar el envejecimiento.
Estructura química de la prolina
La prolina (Pro, P) es uno de los aminoácidos que forman las proteínas de los seres vivos. En el ARN mensajero está codificada como CCU, CCC, CCA o CCG.
Es una molécula hidrófoba. Su masa es 115,13 g mol-1.
La prolina constituye la excepción del grupo de los 20 aminoácidos ya que es un iminoácido (ver Ruta 6). Se considera un aminoácido esencial que forma después de su degradación 2-oxoglutarato. Primero, se transforma en deshidroprolina por medio de la acción de la prolina deshidrogenasa que después de la incorporación de una molécula de agua da lugar al glutamato-g-semialdehído, a partir de éste surge el glutamato después de la acción de la glutamato semialdehído deshidrogenasa. El glutamato es transaminado a 2-oxoglutarato.
La prolina está involucrada en la producción del colágeno. Está también relacionada con la reparación y mantenimiento de los músculos y huesos.
Los ribosomas son complejos supramoleculares encargados de sintetizar proteínas a partir de la información genética que les llega del ADN transcrita en forma de ARN mensajero (ARNm). Sólo son visibles al microscopio electrónico, debido a su reducido tamaño (29 nm en células procariotas y 32 nm en eucariotas). Bajo el microscopio electrónico se observan como estructuras redondeadas, densas a los electrones. Bajo el microscopio óptico se observa que son los responsables de la basofilia que presentan algunas células. Están en todas las células (excepto en los espermatozoides).
En células eucariotas, los ribosomas se elaboran en el núcleo pero desempeñan su función de en el citosol. Están formados por ARN ribosómico (ARNr) y por proteínas. Estructuralmente, tienen dos subunidades. En las células, estos orgánulos aparecen en diferentes estados de disociación. Cuando están completos, pueden estar aislados o formando grupos (polisomas); las proteínas sintetizadas por ellos actúan principalmente en el citosol; también pueden aparecer asociados al retículo endoplasmático rugoso o a la membrana nuclear, y las proteínas que sintetizan son sobre todo para la exportación.
Tanto los ARNr como las subunidades de los ribosomas se suelen nombrar por su coeficiente de sedimentación en unidades Svedberg. En eucariotas, los ribosomas del citoplasma se denominan 80 S. En mitocondrias y plastos de eucariotas, así como en procariotas, son 70 S.
Los ribosomas son los orgánulos encargados de la síntesis de proteínas, en un proceso conocido como traducción. La información necesaria para esa síntesis se encuentra en el ARN mensajero (ARNm), cuya secuencia de nucleótidos determina la secuencia de aminoácidos de la proteína; a su vez, la secuencia del ARNm proviene de la transcripción de un gen del ADN. El ARN de transferencia lleva los aminoácidos a los ribosomas donde se incorporan al polipéptido en crecimiento.
Artículo principal: Síntesis proteica
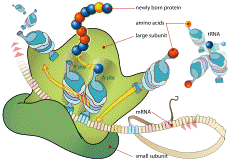
Ribosoma durante la traducción
El ribosoma lee el ARN mensajero y ensambla los aminoácidos suministrados por los ARN de transferencia a la proteína en crecimiento, proceso conocido como traducción o síntesis de proteínas.
Todas las proteínas están formadas por aminoácidos. Entre los seres vivos se han descubierto hasta ahora 20 aminoácidos. En el código genético, cada aminoácido está codificado por uno o varios codones. En total hay 64 codones que codifican 20 aminoácidos y 3 señales de parada de la traducción. Esto hace que el código sea redundante y que haya varios codones diferentes para un mismo aminoácido.
La traducción comienza, en general, el codón AUG que codifica el aminoácido metionina. Al final de la secuencia se ubica un codón que indica el final de la proteína; es el codón de terminación. El código genético es universal porque cada codón codifica el mismo aminoácido para la mayoría de los organismos (no todos).
El ribosoma consta de dos partes, la subunidad mayor y una menor, estas salen del núcleo celular por separado. Las subunidades se mantienen unidas por cargas, y que al disminuir experimentalmente la concentración de Mg+2, las subunidades tienden a separarse.
Por ejemplo, el ARN este:
AUG le indica que tiene que empezar a ensamblar la proteína; es un codón de iniciación.
GCC es Alanina. Coge alanina (un aminoácido) y lo sujeta.
AAC es Arginina, lo une con la alanina.
GGC es Glicina, lo ensambla a la arginina.
AUG era el símbolo de iniciación, pero ya ha comenzado; así que lo interpreta como Metionina. Une el aminoácido metionina con la glicina anterior.
CCU es Prolina. Ensambla la prolina a la metionina.
ACU es Serina. Ensambla la serina con la prolina.
UAA es terminación. Deja de ensamblar la proteína.
Por tanto, la cadena polipeptídica ensamblada ha sido: Alanina-Arginina-Glicina-Metionina-Prolina-Serina
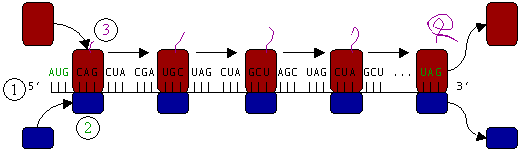
Figura 3: Traducción (1) de ARNm por un ribosoma (2) en una cadena polipeptídica (3). El ARNm comienza con un codón de iniciación (AUG) y finaliza con un codon de terminación (UAG).
Estructura química de la treonina
La treonina (abreviada Thr o T) es uno de los veinte aminoácidos que componen las proteínas; su cadena lateral es hidrófila. Está codificada en el ARN mensajero como ACU, ACC, ACA o ACG.
Su masa es 119,12 g mol -1.
La L-treonina (levo treonina) se obtiene casi preferentemente mediante un proceso de fermentación por parte de los microorganismos (por ejemplo levaduras modificadas genéticamente), aunque también puede obtenerse por aislamiento a partir de hidrolizados de proteínas para su uso farmacéutico.
Asparagina – Cisteina – Glutamina – Serina – Tirosina – Trionina
Arginina – Fenilalanina – Histidina – Isoleucina – Leucina – Lisina – Metionina – Treonina – Triptófano – Valina
Acido aspártico – Acido Glutámico – Alanina – Arginina – Asparagina – Cisteina – Fenilalanina – Glicina – Glutamina – Isoleucina – Metionina – Prolina – Serina – Tirosina – Treonina – Triptófano – Valina
Fenilalanina – Isoleucina – Leucina – Lisina – Tirosina – Treonina – Triptófano
Cortesía de la información científica de MARTINDALE – The Complete Drug Reference
Copyright 2008 Pharmaceutical Press.